病例 1
69 岁男性,既往有抽烟史和震颤,本次因快速进展性痴呆就诊。3 周前,患者出现意识模糊,逐渐加重,震颤也更加明显,记忆力下降,言语错乱,并有行走困难。病程中还存在面肌阵挛,右侧忽视和严重的共济失调。患者血钠稍偏低(133 mmol/L),脑脊液 14-3-3 蛋白阳性,tau 蛋白轻度升高。脑电图提示低电压,左侧半球呈轻度慢波化改变,未见周期性尖慢复合波。
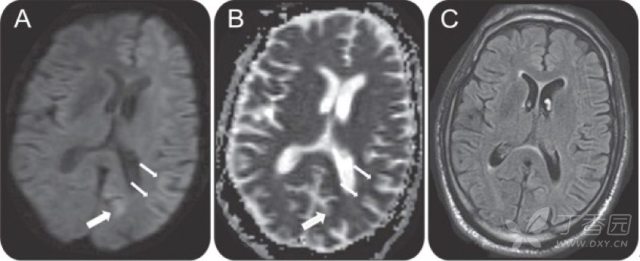
图 1(A-B:DWI 可见左侧大脑半球皮层飘带样高信号,相应部位 ADC 为低信号,提示弥散受限;以左侧楔前叶 [粗箭] 和皮层灰质 [细箭] 最为明显,双侧尾状核和壳核未见明显异常;C:FLAIR 上左侧皮层未见明显高信号)1
根据上述资料,老年男性,快速进展性痴呆+震颤+面肌阵挛+DWI 飘带征,高度怀疑克雅病(CJD)。然而,患者行自身免疫性脑炎抗体检查,发现电压门控钾通道(VGKC)抗体升高,PET 检查提示左侧后部扣带回,后部额叶皮层,枕叶,丘脑和楔前叶高代谢。患者接受免疫治疗后症状明显改善。最终诊断:VGKC 抗体脑炎。
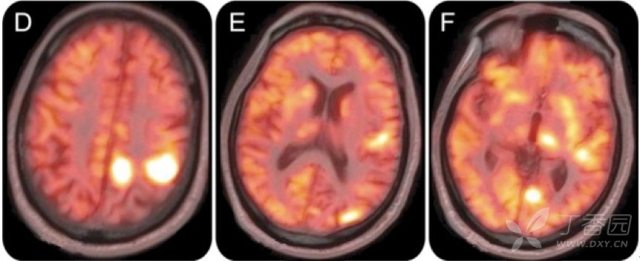
图 2(D-F:左侧后部扣带回,后部额叶皮层,枕叶,丘脑和楔前叶高代谢)1
病例 2
58 岁男性,因间断性意识障碍,记忆力下降和面、手抽动 2-3 月就诊于外院,头颅 MRI 提示右侧尾状核,壳核,双侧颞叶内侧面(左侧明显)T2WI/FLAIR 高信号,DWI 上右侧尾状核和壳核也为高信号,而 ADC 正常。患者血钠稍偏低(131 mmol/L),脑脊液常规和生化无殊,但 14-3-3 蛋白阳性。
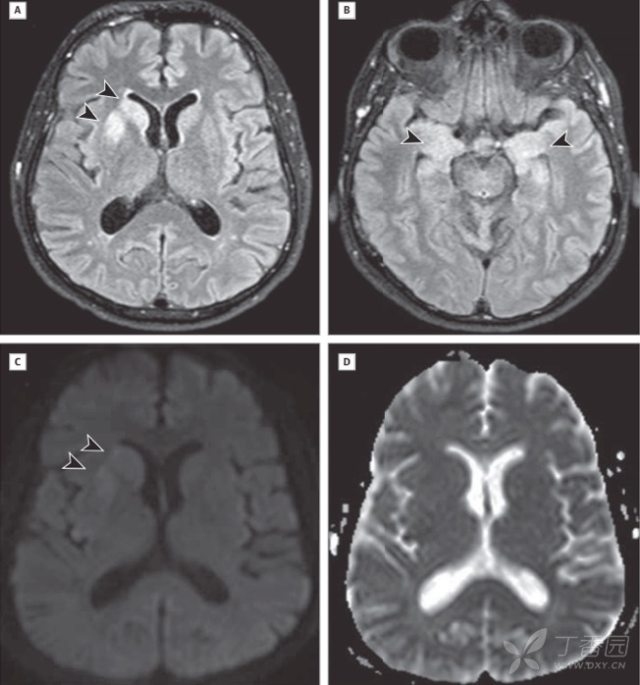
图 3(FLAIR 上可见右侧尾状核和壳核 [A,箭头] 高信号以及双侧颞叶内侧面高信号,左侧更明显 [B,箭头];DWI 提示右侧尾状核和壳核高信号 [C],对应部位 ADC 上未见低信号 [D])2
外院诊断为 CJD。2 月后,患者出现全面性发作,先前症状进一步加重,入院后观察到频繁的面、手抽动(起初认为是肌阵挛),每次持续 0.5-2 秒,无相应的脑电图改变,考虑为面-臂肌张力障碍样发作,但视频脑电图确实也捕捉到数次颞叶癫痫发作。PET 检查提示左侧尾状核和双侧壳核(左侧明显)高代谢。
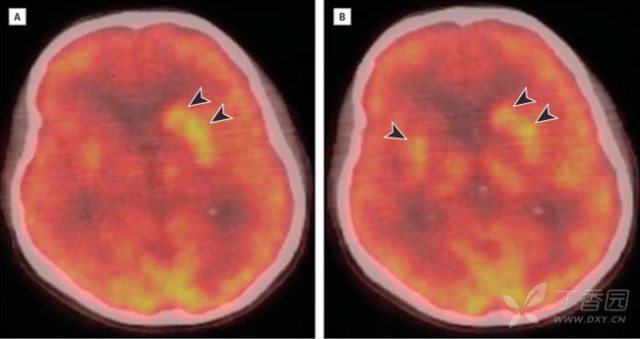
图 4(PET 提示左侧尾状核和壳核高代谢,右侧壳核高代谢不如左侧明显)2
患者行血清自身免疫性脑炎抗体检查,发现 VGKC 抗体升高,接受免疫抑制治疗后症状逐渐好转。最终诊断:VGKC 抗体脑炎。
评论 1:
快速进展性痴呆是指在数周或数月内出现的进行性恶化的认知功能障碍,其包含的疾病谱很广,其中 CJD 占了近半成。临床上碰到快速进展性痴呆合并神经精神异常,肌阵挛,锥体外系,小脑症状或视觉障碍的患者,需考虑 CJD 的可能。影像学上 DWI 对于 CJD 的诊断有很高的敏感性和特异性,常表现为皮层飘带征以及基底节区(特别是尾状核和壳核)高信号。CJD 相对特征性的脑电图改变,即周期性尖慢复合波仅见于 50-70% 的患者,且多在发病 3 个月或以后才出现。脑脊液中以 tau 与 14-3-3 蛋白较为敏感。本病最终明确仍需病理。
VGKC 抗体主要见于神经性肌强直、自身免疫性脑炎、Morvan 综合征等疾病。近来研究显示针对 VGKCs 亚型 Kv1.1 和 Kv1.2 的抗体实际上很少,而参与构成 VGKC 的 LGI1 和 Caspr2 是主要的自身抗原。VGKC 抗体脑炎累及边缘叶较常见,临床上主要表现为认知功能下降,精神症状,癫痫发作和睡眠障碍等。影像学上多可见 T2WI/FLAIR 高信号。血清或脑脊液中 VGKC 抗体阳性有助于诊断。
从上述两例中我们不难发现,VGKC 抗体脑炎可以模拟 CJD 的临床-影像学特征,有时候很难区分。临床角度,两者均可出现快速进展性认知功能下降,精神异常,肌阵挛和锥体外系症状,影像学上,亦都可表现为皮层飘带征和基底节区高信号,脑脊液检查,14-3-3 阳性和 tau 蛋白升高也非 CJD 特有,VGKC 抗体脑炎中也存在类似改变,而脑电图对于鉴别这两种疾病更是无能为力。
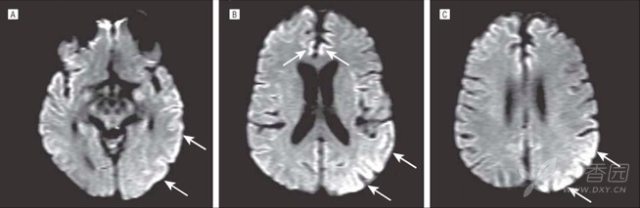
图 5 一例 VGKC 抗体脑炎患者,DWI 上可见皮层高信号 5
这么神似的两种病,应该如何区分呢?首先,从临床角度看,VGKC 抗体(主要为 LGI-1 抗体)脑炎的典型特征之一为面-臂肌张力障碍样发作(如病例 2),需注意与肌阵挛鉴别,避免误诊。前者高度刻板,发作相当频繁(可高达 50 次/天),多为单侧,上臂常和面部运动同步,有时还可累及下肢,发作时间通常比较短暂,一般<3 秒,但相比肌阵挛动作要慢。值得一提的是,VGKC 抗体脑炎还可合并肿瘤,必要时需进行全身筛查。其次,低钠血症是 VGKC 抗体脑炎的另一特征,对诊断有提示意义。再者,从影像学角度,PET 可能有助于鉴别 CJD 和 VGKC 抗体脑炎,排除感染或肿瘤后,高代谢病灶多提示自身免疫过程。最后,也可能最关键的,当然是要查血清和(或)脑脊液中的 VGKC 抗体水平了。
荷兰的一项对 14 年时间(1998-2011)共 384 例怀疑 CJD 的患者尸检研究发现,203 例确诊为 CJD,而余下的 181 例中,有 22 例为自身免疫性脑炎。可见,CJD 诊断时鉴别自身免疫性脑炎相当重要。
看到这里,大家可能觉得问题已经解决了,说来说去,不就是查个抗体吗?只要有抗体升高,就可以排除 CJD,多轻松啊。然而这只是我们的美好愿望而已,事实远没有那么简单。我们再来看 2 个病例。
病例 3
75 岁女性,因快速进展性认知功能缺损入院。10 天前,患者丈夫注意到其短暂的定向力障碍和意识模糊。入院查体发现患者认知领域的所有功能均有下降,运动、感觉和共济正常。脑电图,磁共振及腰穿均为非特异性结果。自身免疫性脑炎抗体筛查血中 Caspr2(VGKC 复合体组成部分之一)抗体阳性。
患者接受免疫治疗后 Caspr2 抗体滴度下降,但症状进一步恶化,复查 MRI 可见 T2WI/FLAIR 基底节区对称高信号,复查脑脊液中 14-3-3 蛋白阳性,tau 蛋白升高。患者起病 1 年左右死亡。尸检证实海绵状脑病。最终诊断:CJD。
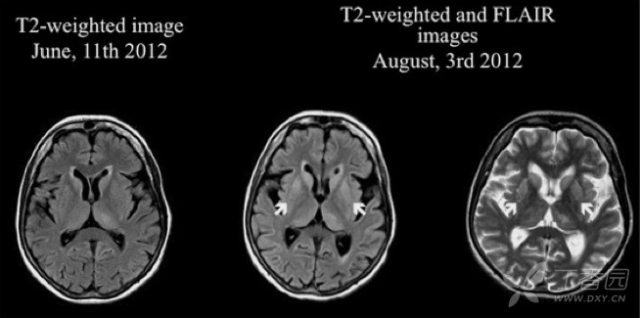
图 6(2 月后的 MRI 上可见基底节区对称 T2WI/FLAIR 高信号,以壳核和尾状核头最为明显)3
病例 4
64 岁女性,进行性步态不稳伴意识模糊 17 月。头颅 MRI 提示基底节区/丘脑和大脑皮层,包括顶叶,枕叶和额叶区域弥散受限。腰穿提示 14-3-3 蛋白阳性,tau 蛋白升高。血清 VGKC 抗体阳性。当时考虑自身免疫性脑炎,准备给予免疫治疗,但尚未开始患者就已死亡,尸检病理学提示海绵状脑病。最终诊断:CJD。
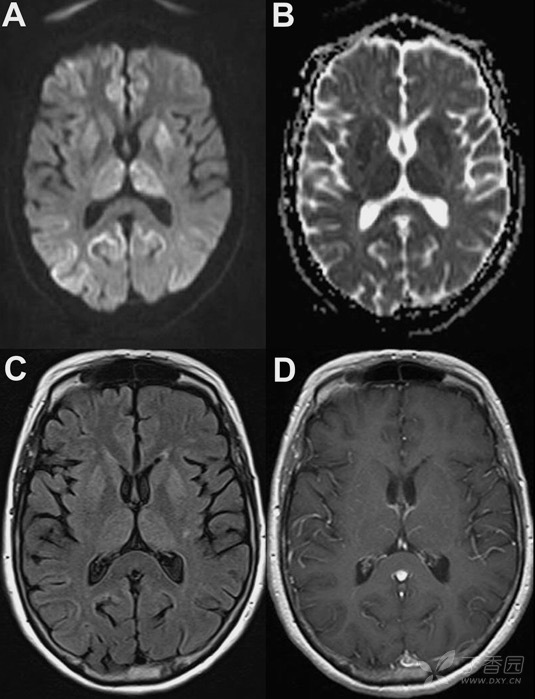
图 7(A-B:DWI 和 ADC 可见皮层和基底节区弥散受限;C:FLAIR 上亦可见部分高信号病灶;D:增强后病灶无明显强化)4
评论 2:
在病例 3 和 4 中,均存在 VGKC 抗体升高,但最终病理确诊为 CJD。可见两者的鉴别还需补充以下几点:首先是病程,比较可靠,怀疑 CJD 的患者如存活 1 年以上特别是超过 2 年时需重新考虑其他诊断;其次是治疗效果,CJD 目前尚不可治,而 VGKC 抗体脑炎多对免疫抑制治疗反应较好。最后,病理依然是终极王牌武器,也是诊断的金标准。
英国的一项研究显示,仅有不到 5% 的 CJD 患者中检测到神经元抗体,即便阳性,滴度也很低。有 3 例考虑可能的 CJD 患者中 VGKC 抗体滴度很高,尽管 2 例未来得及治疗便死亡,但余下 1 例免疫治疗后好转。因此,学者们认为,CJD 患者中合并神经元抗体阳性非常罕见,若抗体滴度很高,更倾向于自身免疫性脑炎的诊断。确诊 CJD 患者中合并 VGKC 抗体阳性的原因尚不清楚,有学者推测朊蛋白介导的神经退行性变可能触发了周围淋巴结的免疫反应,导致产生针对神经元结构(如 VGKC)的抗体。但还需要进一步研究阐明。
总结
VGKC 抗体脑炎(或其他自身免疫性脑炎)和 CJD 可以有相似的临床,影像学,电生理以及实验室检查特点。但一般来说快速进行性痴呆伴局灶性神经功能缺损,如失语,步态异常和视觉障碍等提示 CJD 的可能性大,而癫痫发作,低钠血症和自主神经症状的出现则是自身免疫性脑炎的诊断线索。CJD 是一种致死性疾病,而 VGKC 抗体脑炎(或其他自身免疫性脑炎)绝大多数可治,尽早行抗体检测或可早期诊断,尽早开始免疫抑制疗法或可降低致残率和致死率。
临床上碰到快速进展性痴呆的患者,在诊断 CJD 前需考虑并排除可治性疾病,例如自身免疫性脑炎,特别是 VGKC 抗体脑炎。诊断 CJD 意味着给患者判了死刑,因此一定要慎重。在尚不能明确病因时,可考虑经验性开始一些可治性鉴别疾病的治疗,因为某些可治性痴呆早期干预可能改善患者预后。
对于任何免疫抑制治疗无效的快速进展性痴呆,即便神经元抗体阳性,也应重新评估是否为 CJD。需复查脑脊液,头颅 MRI,脑电图,甚至活检明确。
临床实践中,并没有绝对的事情,只能说一切皆有可能,需要擦亮眼睛,不断思考,方能拨云见日看清真相。
参考文献
1. Fermo OP, Izbudak I, Sutter R, Venkatesan A, Kaplan PW, Probasco JC.Autoimmune encephalitis mimicking Creutzfeldt-Jakob disease.Neurol Clin Pract. 2014 Dec;4(6):493-495.
2. Yoo JY, Hirsch LJ.Limbic encephalitis associated with anti-voltage-gated potassium channel complex antibodies mimicking Creutzfeldt-Jakob disease.JAMA Neurol. 2014 Jan;71(1):79-82.
3. Zuhorn F, Hübenthal A, Rogalewski A, Dogan Onugoren M, Glatzel M, Bien CG, Schäbitz WR.Creutzfeldt-Jakob disease mimicking autoimmune encephalitis with CASPR2 antibodies.BMC Neurol. 2014 Nov 30;14:227.
4. Newey CR, Appleby BS, Shook S, Sarwal A.Patient With voltage-gated potassium-channel (VGKC) limbic encephalitis found to have Creutzfeldt-Jakob disease (CJD) at autopsy.J Neuropsychiatry Clin Neurosci. 2013 Summer;25(3):E05-7.
5. Geschwind MD, Tan KM, Lennon VA, Barajas RF Jr, Haman A, Klein CJ, Josephson SA, Pittock SJ.Voltage-gated potassium channel autoimmunity mimicking creutzfeldt-jakob disease.Arch Neurol. 2008 Oct;65(10):1341-6.
6. Maat P, de Beukelaar JW, Jansen C, Schuur M, van Duijn CM, van Coevorden MH, de Graaff E, Titulaer M, Rozemuller AJ, Sillevis Smitt P.Pathologically confirmed autoimmune encephalitis in suspected Creutzfeldt-Jakob disease.Neurol Neuroimmunol Neuroinflamm. 2015 Nov 12;2(6):e178.
7. Rossi M, Mead S, Collinge J, Rudge P, Vincent A.Neuronal antibodies in patients with suspected or confirmed sporadic Creutzfeldt-Jakob disease.J Neurol Neurosurg Psychiatry. 2015 Jun;86(6):692-4.
8. Grau-Rivera O, Sánchez-Valle R, Saiz A, Molinuevo JL, Bernabé R, Munteis E, Pujadas F, Salvador A, Saura J, Ugarte A, Titulaer M, Dalmau J, Graus F.Determination of neuronal antibodies in suspected and define Creutzfeldt-Jakob disease.JAMA Neurol. 2014 Jan;71(1):74-8.
9. Chen Y, Xing XW, Zhang JT, Wang RX, Zhao W, Tan QC, Liu RZ, Wang XQ, Huang XS, Yu SY.Autoimmune encephalitis mimicking sporadic Creutzfeldt-Jakob disease: A retrospective study.J Neuroimmunol. 2016 Jun 15;295-296:1-8.
