病例重现
男性,20 岁,因癫痫持续状态入急诊,父母诉患者共有 7 次全面强直 - 阵挛发作,伴向上凝视,每次发作持续时间约 1 到 2 分钟。
既往患者先前曾经历 2 次全身性强直 - 阵挛性发作,一次在 2 岁时,一次在 14 岁时,均与发热性疾病有关。 家族史(-)。
查体:嗜睡,查体部分合作。四肢肌力 V 级。
辅助检查:头颅 CT:右侧枕区有低密度。头颅 MRI 显示了与同一区域的局部缺血相一致的病灶;MRA 和 MRV 正常;脑电图(EEG):轻度脑病改变,而无癫痫样活动。脑脊液乳酸(7.5)血清乳酸(8.0)均显著升高。
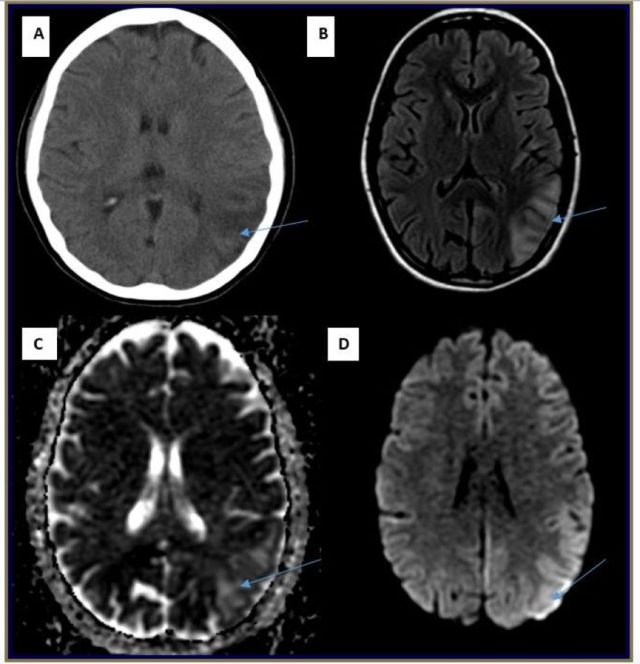
图:(A)CT 提示右侧枕叶低密度灶;(B)Flair 提示与血管分布不匹配的右侧枕叶高信号病灶,呈缺血性改变。(C、D) ADC/DWI 提示缺血性改变
考虑到患者病灶不符合血管分布,同时血清和 CSF 乳酸升高,故诊断考虑为:线粒体脑病伴乳酸中毒及卒中样发作 (MELAS)。
患者开始静脉注射精氨酸,在 72 小时内症状消失。线粒体 DNA 测序发现 m.3243A> G 处发生 51% 的异质性突变,这是与 MELAS 相关的最常见基因突变。
病例讨论:
线粒体脑病伴乳酸中毒及卒中样发作 (MELAS),是一组累及神经系统的异质性疾病。大约 80% 的 MELAS 病例与编码 tRNA-亮氨酸的 MT-TL-1 基因中 m.3243(A> G)这一位点突变相关。该基因原功能为使牛磺酸对线粒体 tRNA-亮氨酸进行转录后修饰,突变后引起该基因功能缺失从而破坏线粒体的蛋白合成。因为它是通过线粒体 DNA 遗传的,所以该突变显示为不同程度的母系遗传。
1. 病理生理机制
卒中样发作是 MELAS 的典型特征,病灶不符合血管分布。越来越多的证据表明,MELAS 的卒中发作,部分是由于异常一氧化氮代谢导致血管舒张功能受损所致。内皮依赖性血管舒张由一氧化氮代谢介导的,而精氨酸在这个过程中是至关重要的。在卒中发作的急性期,MELAS 患者精氨酸水平较低。据推测,缺乏精氨酸可阻止了一氧化氮的产生,并导致血管收缩、低氧血症及中风样发作。
2. 诊断
MELAS 最容易被识别的是乳酸酸中毒。电子传递链的障碍导致 ATP 产生减少, 糖酵解增加及丙酮酸增多, 而丙酮酸过多会生成丙氨酸或被还原为乳酸。
尿液分析显示乳酸升高,血液分析显示丙氨酸升高。MELAS 患者的脑脊液中可出现蛋白质、乳酸、丙酮酸和白细胞的升高, 当脑脊液中的乳酸升高伴卒中样发作,需要考虑线粒体脑肌病的可能。
急性卒中发作时,MRI 通常显示病灶 DWI 高信号,T2 和 FLAIR 高信号,这些病灶通常不遵循血管分布。受累病灶的 ADC 信号可有增加、减少或混合, 这表明细胞毒性水肿(ADC 低信号)和血管性水肿(ADC 高信号)可同时存在。
受累病灶区域常累及皮质与皮层下,并不涉及深部白质。磁共振波谱可以检测到是否存在乳酸峰。影像学往往随临床症状的改善而消失,但可能会软化灶,尤其是在疾病晚期。
80%MELAS 患者, 可通过抽血来发现线粒体 DNAm.3243A>G 的点突变,剩余 20% 患者,其基因突变可能发生在线粒体其它位点或核 DNA 中。对于基因检测阴性的患者,需要进行肌肉活检。
3. 治疗
卒中样发作期间显示 MELAS 患者的一氧化氮代谢物浓度较低,而精氨酸和瓜氨酸可作为一氧化氮前体。口服或静脉注射精氨酸或瓜氨酸可增加一氧化氮的利用率,减少 MELAS 患者卒中样发作的持续时间及严重程度。
出现中风样发作的 MELAS 患者应该静脉注射盐酸精氨酸的负荷剂量。最佳剂量尚未确定,但应在症状出现后,尽快给予持续 24 小时大剂量精氨酸静脉输注,剂量为 0.5 g / kg,持续 3 至 5 天,同时给予生理盐水维持脑灌注。
应尽快给予葡萄糖注射液,以逆转正在进行或即将发生的分解代谢。若出现精神状态的改变或脑病的临床表现,患者应接受 EEG 评估是否存在亚临床癫痫持续状态。
一旦 MELAS 患者出现卒中样症状, 应给予口服精氨酸 0.15-0.3 g/kg/日,以增加精氨酸储备的基础量预防卒中样发作。
